炎色反応の原理
原子は熱せられたり電気放電に会うと、エネルギーを吸収し励起状態になる。しかし励起状態は不安定で、すぐに元の基底状態へと戻る。このときのエネルギー差が光として放出され、この光の波長が可視部にある時に、炎色反応が観測できる。
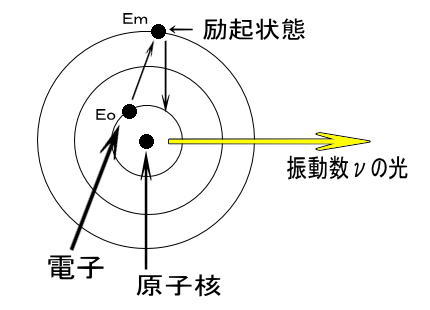
この光の波長は連続ではなく、とびとびの値になっている。エネルギー差ΔE と光の振動数 ν の間には、
ΔE = hν (h: プランクの定数 6.63×10-34)
の関係があり、エネルギー差が小さいと振動数が小さくなり、波長が長くなる。
炎色反応の色
| 金属 |
Li |
Na |
K |
Ca |
Ba |
Rb |
| 炎色 |
深赤 |
黄 |
赤紫 |
橙赤 |
青緑 |
赤紫 |
|
金属
|
Cu |
Tl |
Ga |
Sb |
As |
Sn |
| 炎色 |
青緑 |
黄緑 |
青 |
淡青 |
淡青 |
淡青 |
| 金属 |
Pb |
In |
Cs |
| 炎色 |
淡青 |
藍 |
青紫 |
花火もこの炎色反応をうまく利用して美しい色、形を作っている。

